Виды химической связи
Практически все химические элементы, кроме инертных газов, способны образовывать химические соединения – молекулы. При этом, между атомами таких элементов образуется связь. В различных соединениях связь отличается. Это зависит от природы элементов, их электроотрицательности, наличию свободных орбиталей.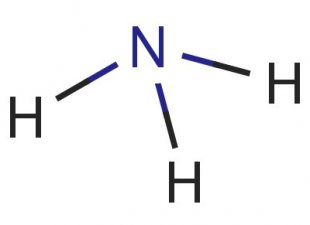 Так, одна из самых распространенных связей – ионная связь образуется только между атомом металла и неметалла. При этом, металл, как менее электроотрицательный, передает свои электроны неметаллу. Первый становится положительным, а второй – отрицательным.
Так, одна из самых распространенных связей – ионная связь образуется только между атомом металла и неметалла. При этом, металл, как менее электроотрицательный, передает свои электроны неметаллу. Первый становится положительным, а второй – отрицательным.
Между атомами неметаллов образуется ковалентная полярная и неполярная связь, механизм формирования которой одинаков в обоих случаях. Эта связь образуется за счет образования единой электронной пары. Причем, если атомы одинаковые по электроотрицательности (относятся к одному элементу), то связь будет неполярная – электронная пара будет равноудалена от обоих атомов. Если же атомы отличаются, то электронная плотность будет смещаться к более электроотрицательному элементу и молекула будет приобретать частичный положительный и частичный отрицательный заряд. В этом случае связь называется ковалентная полярная.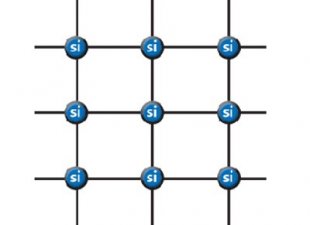 Между металлами в независимости от того одинаковые они или разные, образуется металлическая связь. Она представляет из себя образование единой сети из положительных ядер атомов, между которыми свободно перемещаются электроны. В этом случае, электроны перестают принадлежать одному атому и могут переместиться на любое расстояние. За счет этого свойства металлической связи возможна передача электричества (электронов) на большие расстояния.
Между металлами в независимости от того одинаковые они или разные, образуется металлическая связь. Она представляет из себя образование единой сети из положительных ядер атомов, между которыми свободно перемещаются электроны. В этом случае, электроны перестают принадлежать одному атому и могут переместиться на любое расстояние. За счет этого свойства металлической связи возможна передача электричества (электронов) на большие расстояния.
В химии выделяется одна связь, которая не является истинной химической связью. Это уникальная и удивительная химическая водородная связь, потому что передачи электронов не происходит. В этом случае связь образуется за счет электростатического притяжения (плюс к минусу). Это одна из самых слабых видов связи, ее очень легко разрушить (можно наблюдать при переливании воды – капли легко отделяются друг от друга). В биологических системах эта связь широко распространена и удерживает друг с другом молекулы. Ее сила связана с тем, что на небольшом расстоянии расположено огромное количество мостиков такой связи и вместе они образуют мощную силу.
Последний вид химической связи – донорно-акцепторная. В этом случае один элемент предоставляет свободную орбиталь (донор), а второй размещает на ней свою пару электронов (акцептор). Такая связь присутствует в катионе аммония, где один из водородов присоединяется по такому механизму и общий заряд молекулы становится положительным.

Комментариев 0